Las autoridades de Baja California llevaron a cabo el cierre de 31 farmacias en el estado, debido a la venta irregular de medicamentos que posiblemente contenían fentanilo.
Dicha sustancia es un potente analgésico opioide similar a la morfina, pero entre 50 y 100 veces más potente.
La Comisión para la Protección contra Riesgos Sanitarios (Cofepris) y la Secretaría de Marina (Semar) implementaron el operativo ‘Albatros II’ en Baja California para detectar estos productos.
México Habla te invita a leer: PAN aprueba senadurías plurinominales de Marko Cortés, Lilly Téllez y Mauricio Vila
Esa estrategia resultó en la suspensión de 31 farmacias o puntos de venta por la comercialización irregular de medicamentos, posiblemente contaminados con fentanilo.
De igual manera, la Cofepris informó, mediante un comunicado, que la acción se llevó a cabo gracias a denuncias ciudadanas.
«Sentando un precedente en la región que recibe millones de turistas anualmente», señalaron.
Se indicó que, cuando la autoridad recibió las denuncias, se analizó la información sobre diversas irregularidades sanitarias.
Lo anterior originó la ejecución del operativo,
Ante ello, la autoridad desarrolló 53 visitas de verificación en igual número de establecimientos, cuyos resultados se resumen en la suspensión de actividades en 31 farmacias.
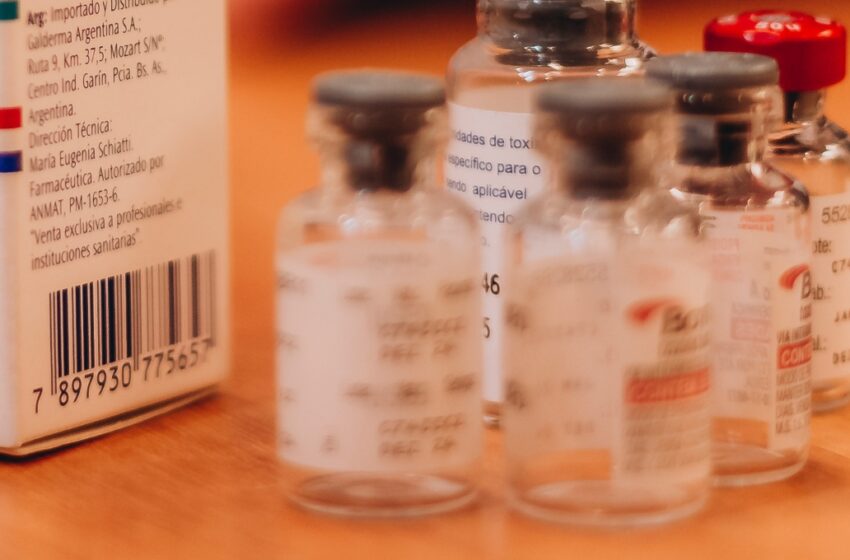
También, aseguraron cuatro mil 681 cajas de medicamentos y, realizaron muestreos para analizar posibles falsificaciones, adulteraciones o presencia de fentanilo en los productos.
Han advertido a la población para que evite comprar medicamentos fuera de las farmacias autorizadas.
Por ello, la dependencia reafirmó su compromiso de proteger a la población contra establecimientos que incumplen las normas vigentes.
También puedes leer: Habitantes se enfrentan a grupo criminal en Texcaltitlán; deja 11 muertos
Los operativos de la Cofepris buscan evitar que las personas adquieran medicamentos falsificados o caducados, así como aquellos que contienen sustancias nocivas para la salud,